Регенерація ушкоджень шкірного покриву
Розберемо основні аспекти регенерації шкірного покриву.
Механізми загоєння ран та формування рубців вивчаються дуже давно. Але навіть сьогодні є багато молекулярних нюансів, які не до кінця вивчені. У практиці дерматокосметолог важливо розуміти основи процесів відновлення структур шкіри для проведення безпечних і ефективних процедур.

Ольга Маслова , кандидат біологічних наук, клітинний біолог
Загоєння рани важливо розглядати на загальнофізіологічному рівні з урахуванням системних реакцій організму. Кліткових біологів цікавлять насамперед міжклітинні комунікації та молекулярні каскади, що їх забезпечують. Запитання настільки складні, що майже кожна наукова стаття закінчується різними варіаціями фраз на тему «потрібне подальше вивчення».
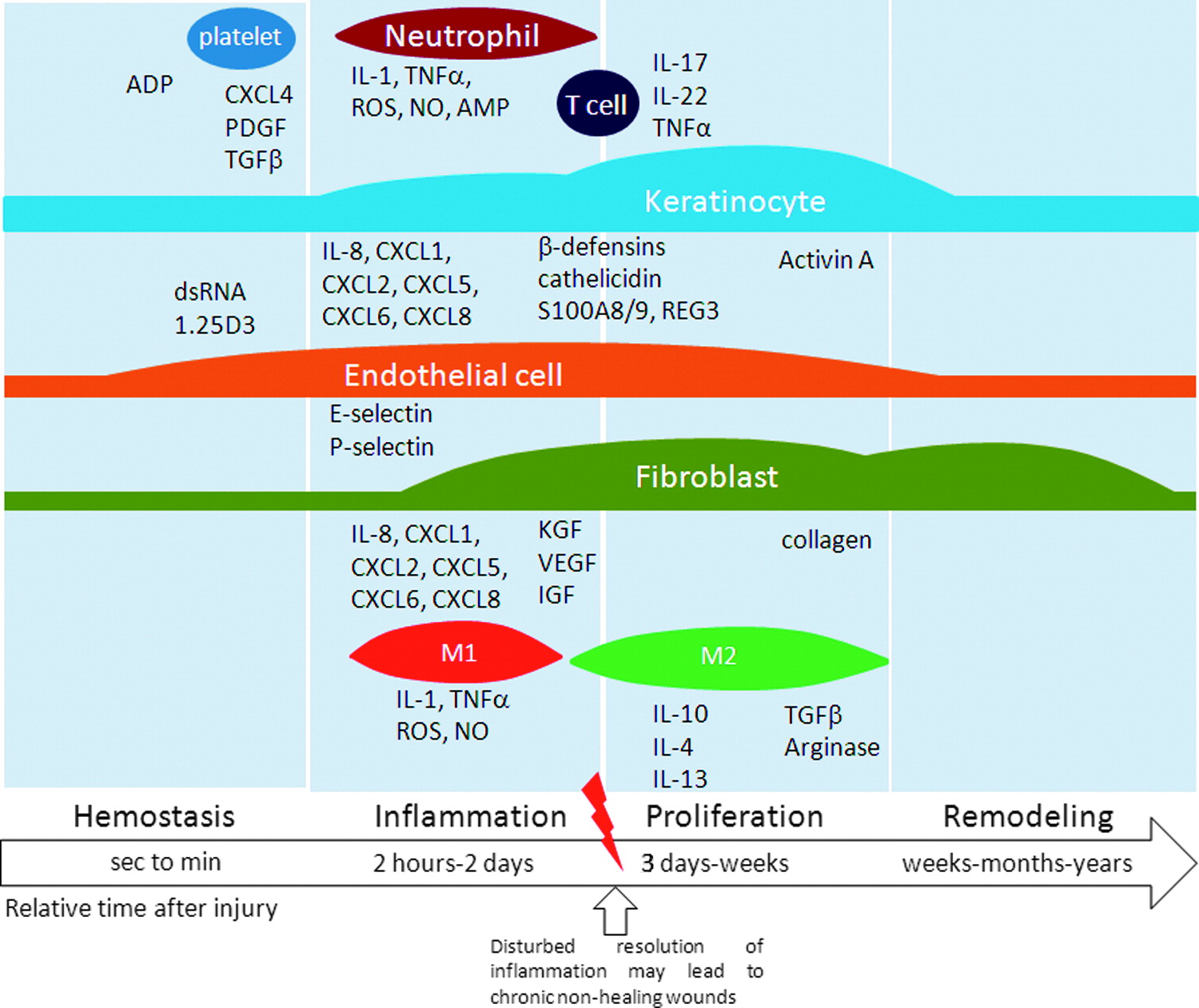
Існує кілька класифікацій стадій загоєння рани. Залежно від типу ушкодження та інших особливостей деякі стадії можуть виявлятися різною мірою, але загалом можна назвати наявність наступних етапів.
Найпершою і часто дуже короткою (як правило, що вимірюється в хвилинах, оскільки займає від секунд до декількох годин) фазою є гемостаз - тобто процес згортання крові, який залучає в рану тромбоцити і лейкоцити. Окремо процес коагуляції крові та формування згустку детально описаний.
Безпосередньо для загоєння рани важливим є факт вивільнення ряду сигнальних молекул з альфа-гранул тромбоцитів, який вже можна вважати частиною наступної стадії - запалення , яка триватиме від кількох годин до кількох діб, а в деяких випадках може затягтися на більший період. Ця фаза характеризується високою активністю імунних клітин, головним чином нейтрофілів, які борються з інфекцією, а також виділяють свої сигнальні молекули, здатні координувати діяльність інших клітин.
На цьому ж етапі в роботу включаються макрофаги, які в залежності від типу можуть виконувати різні функції: макрофаги М0 - спокоюються, М1 - беруть участь у цій фазі (прозапальні), М2 - беруть участь у наступній фазі проліферації (протизапальні або репаративні).
Макрофаги не лише «прибирають сміття» за нейтрофілами (фагоцитуючи дебрис, залишки інфекційних агентів), а й виділяють безліч сигнальних молекул, що залучають до процесу інші типи клітин. У фазі запалення беруть участь різні імунні клітини, залежно від потреби та властивостей ушкодження.
Наступною фазою вважають фазу проліферації , тобто відновлення кількості клітин. Тут уже в роботу вступає протизапальна популяція макрофагів та головні гравці – фібробласти. На цьому етапі важливо прибрати всю «істерику» імунної системи, тому що організм (при успішному проходженні попередньої фази) отримує сигнал про те, що «ворог розбитий» і настав час знижувати інтенсивність агресивних дій і потихеньку прибирати поле бою і механічно забудовувати територію.
Фібробласт - одна з найзагадковіших клітин нашого організму. Кліток цього типу багато, вони зустрічаються в різних місцях, але головною особливістю фібробласта в процесі загоєння пошкодження є його динамічність і спорідненість з мезенхімальною мультипотентною клітиною. Існує кілька класифікацій фібробластного дифферону та різні формулювання визначення близькості до мезенхімальної мультипотентної клітини, але грубо можна представити фібробласт як якийсь функціональний стан, який за одних умов забезпечує синтез позаклітинного матриксу та виділення однієї групи сигнальних молекул, а за інших умов – «переформатується» в пролі активну клітину з іншим набором сигнальних молекул, що виділяються.
Для загоєння рани дуже важливим є процес "епітеліально-мезенхімальних переходів" , який характеризується тим, що умовно рухливий мезенхімальний фенотип дозволяє клітині переміститися в місце найбільшої потреби, а там "заякоритися" і перетворитися на елемент стабільного епітелію, клітини якого не здатні пересуватися. У нормі такі переходи відбуваються лише у процесі внутрішньоутробного розвитку та загоєння рани. Вони є важливою частиною розвитку онкологічних захворювань, оскільки беруть участь у поширенні пухлинних клітин. Фібробласт у загоєнні рани працює і як "будівельник", і як "менеджер" - регулюючи проліферацію та роботу інших типів клітин.
На етапі відновлення , крім фібробластів, до процесу підключаються і самі мультипотентні клітини, проте відрізнити їх у цих умовах не завжди є можливим. Різні функціональні стани фібробластів – від наближеного до ранньо-мезенхімального до міофібробласту, характеризуються різними властивостями та завданнями (іноді протилежними за ефектом). Багато робіт зараз присвячено саме взаємодіям фібробластів з іншими типами клітин. З'ясовується, що фібробласт може «знайти підхід» до багатьох клітинних типів і, залежно від ситуації, здатний виділяти різні речовини, що модулюють роботу «колег». Залежно від тяжкості пошкодження фаза проліферації може зайняти від декількох днів до декількох тижнів і включати відновлення безпосередньо шкірного покриву, так і більш глибоку роботу з підключенням реконструкції васкуляризації та іннервації. Відповідно, залучатись у таких випадках будуть різні групи клітин.
На етапі відновлення важливу роль відіграють стовбурові клітини різного ступеня потентності від мультипотентних до уніпотентних (клітини-попередниці) та різного ембріонального походження, тому що потрібно пошарово відновити всю тканинну структуру та паракринно «керувати» всіма регенеративними процесами. Відомо, що стовбурові клітини шкіри представлені похідними різних зародкових листків: у базальному шарі епідермісу знаходяться клітини, що утворилися з ектодерми, в дермі - з мезенхіми, у волосяних фолікулах - з нервового гребеня, плюс існує окрема популяція - попередники міла. Кожен із цих типів виконує свої завдання, відновлюючи тканину та повертаючи мікрооточення у спокійний стан. При великих пошкодженнях, що призводять до системної реакції, часто в осередок «приходять» стовбурові клітини із сусідніх шарів або навіть великих депо мультипотентних клітин. Це відбувається завдяки явищу під назвою хоумінг – здатності стовбурової клітини переміщатися за екстреним викликом. За допомогою рецепторів на своїй поверхні клітина вловлює сигнали про допомогу і «прямує» градієнтом концентрації хімічного сигналу в місце, де потрібна в даний момент найбільше.
Наступним етапом є ремоделювання , яке може відбуватися протягом тривалого періоду. На цьому етапі заміщаються всі створені фібробластами «на швидку руку» конструкції: замінюються колагени, упорядковується вид на місці рани і все повертається в максимально наближену до періоду «до пошкодження» форму. Успіх цієї фази залежить від ступеня пошкодження та регенеративного потенціалу організму.
На кожному з етапів, на жаль, може статися збій і тоді організм має справу з патологічним ранозагоюванню, яке може виражатися по-різному. Іноді фібробласти можуть «занадто халатно поставитися» до естетики процесу і перегнути із синтезом колагену, не відстеживши його характеристики — тоді, наприклад, з'являються рубці та шрами. Іноді всі процеси йдуть з помилками (особливо це може виражатися на межі фаз запалення та проліферації) і загоєння не завершується, приводячи до хронічних ран і навіть виразок.
Джерело: The Innate Immune System in Acute and Chronic Wounds 2015 DOI: 10.1089/wound.2014.0608
*Гемостаз – запалення – проліферація – ремоделювання; Від секунд до хвилин --- 2 години – 2 дні --- 3 дні – тижні --- тижні-місяці-роки; Відносний час після травми; Порушений дозвіл запалення може призвести до хронічних ран, що не гояться.
В цілому на ефективність загоєння рани може впливати безліч факторів, серед яких генетичні особливості, стан і кількість стовбурових клітин (різних типів), локалізація ушкодження, різний рівень експресії факторів росту, цитокінів і т. д., вік, наявність захворювань (особливо діабету) ), картина існування мікробіома та інфекції в організмі, циркадний ритм, робота катехоламінової системи, баланс нейромедіаторів, фаза циклу для жінок.
Вперше опубліковано: Косметолог № 1, 2019
Читайте також
- Космецевтика в дії: відновлення шкіри в області шиї та декольте
- Інтенсивні ушкоджувальні процедури: як скоротити реабілітаційний період
- Регенерації шкіри: біологія процесу та методи його стимуляції
- Стимулювання метаболізму шкіри: можливості трансмембранного протеїну
- Онлайн-конференція «Стимульована регенерація шкіри: як мінімізувати ризики і досягти тривалого результату»
- Ін'єкційні можливості лікування гіпертрофічних рубців
- Патогенетичні особливості гіпертрофічних рубців